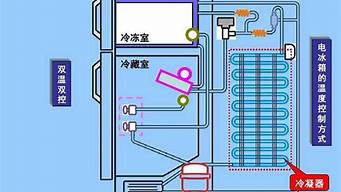
冰箱制冷原理热力学第二定律_热力学第二定律冰箱工作原理
接下来,我将通过一些实际案例和个人观点来回答大家对于冰箱制冷原理热力学第二定律的问题。现在,让我们开始探讨一下冰箱制冷原理热力学第二定律的话题。
1.如何理解热力学第二定律
2.热力学第二定律
3.热力学第二定律的应用
4.热力学第二定律是什么

如何理解热力学第二定律
热力学第二定律用物理学的语言告诉我们没有什么是永恒的。它指出可以做功的能量会越来越少,这一过程虽然缓慢,却确实存在。不管是冰箱的运转,还是宇宙黑洞的物理规律,都遵循热力学第二定律。有些宇宙学家甚至在思考,这一定律会不会带来宇宙的终结。
热力学第二定律用物理学的语言告诉我们没有什么是永恒的。它指出可以做功的能量会越来越少,这一过程虽然缓慢,却确实存在。不管是冰箱的运转,还是宇宙黑洞的物理规律,都遵循热力学第二定律。有些宇宙学家甚至在思考,这一定律会不会带来宇宙的终结。
由于有热力学第二定律这一物理法则,发动机或者其他把热(系统以温度形式储藏的能量)转化为物理运动(功)的效率都会受到限制。例如,蒸汽机把热蒸汽转化为火车动能从而推动火车前进,但蒸汽机并不能以100%的效率完成这一过程,会有一定量的热能损失在环境中。
由于有热力学第二定律这一物理法则,发动机或者其他把热(系统以温度形式储藏的能量)转化为物理运动(功)的效率都会受到限制。例如,蒸汽机把热蒸汽转化为火车动能从而推动火车前进,但蒸汽机并不能以100%的效率完成这一过程,会有一定量的热能损失在环境中。
热力学第二定律
热力学第二定律是限定实际热力学过程发生方向的热力学规律。它证实熵增加原理成立:达到平衡态的热力学系统存在一个态函数熵,孤立系的熵不减少,达到平衡态时的熵最大。这就是说,热力学第二定律要求:孤立系中发生的过程沿着熵增加的方向进行,称为熵判据。它与热力学第一定律和热力学第三定律一起,构成了热力学理论的基础。由它引出的卡诺定理指出了提高热机和制冷机经济性的方向和限度。经验指出热功转换是不可逆的,热功转换不可逆性可以在大量的热机循环中观察到,无法制成一个只从高温热源吸热而不放热到低温热源的循环动作的热机。经过总结大量实践得到结论:不可能从单一热源吸取热量,使之完全变为有用的功而不产生其他影响。这就是热力学第二定律的开尔文表述。它否定了制作第二类永动机(见永动机)的可能性。除热功转换不可逆性外,热量传递也是不可逆的:热量总是自发地从高温物体传递到低温物体,而相反的过程是不可能自发地进行的。在大量实验的基础上,克劳修斯总结出热力学第二定律另一种表述:不可能把热量从低温物体传递到高温物体而不产生其他影响。
从微观上看,与其他宏观现象一样,不可逆现象也是由大量粒子组成的系统在宏观上表现出来的统计规律性。在一定的宏观条件下,大量粒子组成的系统可取的微观态以及与之相关的宏观态都是偶然事件,各自以一定的概率发生。概率大的宏观态在实验中被观测到的机会要多。系统的平衡态是给定宏观条件下概率最大的宏观态。对于一个由大量粒子组成的系统与其平衡态相应的概率远大于其他宏观态的概率。因此,宏观系统中自发进行的不可逆过程,实际上是在给定条件下系统从概率较小的宏观态向概率较大的宏观态转变的过程;当系统达到概率最大的宏观态后,自发过程停止,达到了平衡态。
宏观态出现的概率与它包含的微观态的数目有关。一种宏观态所对应的微观态的数目称为热力学概率。热力学概率越大,这种宏观态在实验中被观测到的机会越多。平衡态是热力学概率W最大的宏观态,具有确定的数值 ,故若用玻耳兹曼公式定义平衡态的熵为S=klnW,则系统中自发进行的由概率较小的状态过渡到概率较大的状态的不可逆过程是一个熵增加的过程,从而在微观上解释了熵增加原理。
热力学第二定律的应用
热力学第二定律,也被称为熵增原理,是热力学中的一个基本定律。它描述了自然界中热现象发生的方向性和不可逆性,提供了对热过程进行评估的方法。热力学第二定律的表述有多种,其中最常见的是卡诺定理和熵增原理。
卡诺定理指出,在所有可能的热机中,卡诺热机的效率最高。具体而言,卡诺热机的效率与工作温度之比无关,只与工作物质的初温和末温有关。该定理表明,不存在能从单一热源吸热完全转化为有用功的热机,总会有一部分热量以废热的形式被释放。
熵增原理是热力学第二定律的另一种表述方式。熵是描述系统无序程度的物理量,可以理解为系统的混乱程度。熵增原理指出,孤立系统的熵在一个可逆过程中保持不变,在一个不可逆过程中增加。换句话说,自然界中任何一个孤立系统都会趋向于更大的熵,即系统内部的无序性将不断增加。
熵增原理的实际意义在于,它限制了热力学过程的方向性。根据熵增原理,一个热力学过程只有在系统与外界之间传递热量的过程中才能发生,而不会逆向发生。这解释了为什么热量总是从高温物体流向低温物体,而不会反向流动。同时,熵增原理还解释了为什么自然界中的过程总是趋于一个热平衡状态,即熵最大化的状态。
热力学第二定律的意义在于限制了热能的利用和转化过程。热力学第二定律是描述自然界热现象方向性和不可逆性的基本定律。无论是通过卡诺定理还是熵增原理等形式表述,它提供了对热过程进行评估的方法,同时解释了为什么热量只能从高温物体流向低温物体,以及为什么自然界中的过程总是趋于热平衡状态。
热力学第二定律是什么
热力学第二定律是热力学中的重要定律之一,它指出了自然界中热量的流动方向,以及能量转换的效率限制。本文将讨论热力学第二定律在现代工程技术和生物学领域中的应用。一、工程技术领域1. 热力学中的热机效率
热力学第二定律指出,任何热机的效率都受到限制,无法达到100%。因此,对于热机的设计和工作优化,要考虑如何提高效率。现代内燃机、蒸汽发动机、风力涡轮机等都是基于热力学第二定律的基础上进行设计和工作优化的。
2. 制冷技术的应用
热力学第二定律也指出了制冷技术的效率限制。因此,目前制冷技术多采用吸收式、压缩式制冷方式,并通过采用新颖的材料和设计,来提高制冷效率和减少能量的消耗。
3. 可再生能源的利用和开发
热能转化是可再生能源的核心,包括太阳能、生物质能、地热能、海洋能等,这些能源的开发和利用都需要热能转化技术的支持,而热力学第二定律可以指导可再生能源的最大限度转化和应用。
二、生物学领域
1. 细胞能量转化
细胞代谢过程中产生的热能,要通过酶催化途径转化为其他形式的能量,用于细胞内各种生物学过程的支持。热力学第二定律的应用可以指导细胞内热能转化的最大效率,从而保证细胞代谢的稳定性。
2.生命的降熵过程
热力学第二定律可以用于解释生命为什么可以保持自身的稳定性和秩序性。因为热力学第二定律指出了自然界中热量的流动方向是从高温区流向低温区,即热量总是流向混乱状态。而生命是通过消耗能量,将自身维持在一个低熵状态下,从而保持秩序性和稳定性的。
综上所述,热力学第二定律在现代工程技术和生物学领域中具有重要的应用价值,可以指导我们如何进行能量转化的优化和最大化利用,从而提高能源使用效率和保护环境,同时也揭示了生物体维持内部稳定性和秩序性的机制和原理。
热力学第二定律(second law of thermodynamics),热力学基本定律之一,表述如下:克劳修斯表述为:热量不能自发地从低温物体转移到高温物体。开尔文表述为:不可能从单一热源取热使之完全转换为有用的功而不产生其他影响。熵增原理:不可逆热力过程中熵的微增量总是大于零。在自然过程中,一个孤立系统的总混乱度(即“熵”)不会减小。
第二定律在有限的宏观系统中也要保证如下条件:
1、该系统是线性的。
2、该系统全部是各向同性的。
另外有部分推论:比如热辐射:恒温黑体腔内任意位置及任意波长的辐射强度都相同,且在加入任意光学性质的物体时,腔内任意位置及任意波长的辐射强度都不变。
洛施密特悖论:
洛施密特悖论,又称可反演性悖论,指出如果对符合具有时间反演性的动力学规律的微观粒子进行反演,那么系统将产生熵减的结果,这是明显有悖于熵增加原理的。
针对这一悖论,玻尔兹曼提出:熵增过程确实并非一个单调过程,但对于一个宏观系统,熵增出现要比熵减出现的概率要大得多;即使达到热平衡,熵也会围绕着其最大值出现一定的涨落,且幅度越大的涨落出现概率越小。已有的一些实验结果,与玻尔兹曼的叙述基本相符。
今天关于“冰箱制冷原理热力学第二定律”的探讨就到这里了。希望大家能够更深入地了解“冰箱制冷原理热力学第二定律”,并从我的答案中找到一些灵感。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。